Feline Infektiöse Peritonitis (FIP)
Wenn bei Ihrer geliebten Katze der Verdacht auf Feline Infektiöse Peritonitis, kurz FIP besteht oder die Diagnose FIP gestellt wird, werden Sie sehr schnell sehr viele Fragen haben. Nicht auf alle gibt es eine schnelle und vor allem nicht einfache Antwort. Die Erforschung dieser Krankheit ist aktuell in vollem Gang und es ergeben sich laufend neue Erkenntnisse.
VetServices will helfen Ihre Fragen zu beantworten, Ihnen Angst zu nehmen und sich zu informierten, denn die FIP ist nicht länger ein Todesurteil, sondern behandelbar!
Eine klinisch manifeste FIP führt ohne spezifische Behandlung binnen weniger Wochen zum Tod, vor allem jüngere Tiere mit der „feuchten Form“ haben ohne Behandlung eine geringe Überlebenszeit. 2018 konnte Niels C. Pedersen in einer Studie nachweisen, dass GS-441524, der Hauptmetabolit des humanen Medikaments Remdesivir bei FIP hochwirksam ist und die Katzen geheilt werden konnten. Diese Ergebnisse wurden am 13. Februar 2019 im Journal of Feline Medicine and Surgery (JFMS) veröffentlicht. In einer Münchner Studie aus dem Jahr 2021 konnten alle 18 Tiere mit diesem Wirkstoff geheilt werden, wobei sich der Wirkstoff als gut verträglich erwies.
Was ist eine Feline Infektiöse Peritonitis? Was ist FIP?
FIP ist eine weltweit durch das Feline Coronavirus ausgelöste Infektionskrankheit, die ausschließlich Katzen (Felidae) befällt. Der Name leitet sich von der häufigsten klinischen Form, einer Bauchfellentzündung (Peritonitis) ab. Kommt es zu einer klinischen Erkrankung, endet diese unbehandelt in aller Regel tödlich. Erst seit 2016 bzw. 2018 gibt es zwei neue experimentelle Wirkstoffe (GC376 und GS-441524), die in mehreren Studien erfolgreich zur Behandlung von FIP eingesetzt wurden. Da diese Wirkstoffe nicht als Tierarzneimittel zugelassen sind, ist ihr Einsatz in der EU nach Art. 112 Verordnung (EU) 2019/6 über Tierarzneimittel nicht erlaubt und Tierärzte machen sich nach dem Arzneimittelgesetz bei Anwendung strafbar.
Wie entsteht eine FIP?
Ursache, Inkubationszeit, Verbreitung

Die Ursache für die FIP ist ein hoch virulentes Coronavirus, das Alphacoronavirus 1, das heute als Felines Coronavirus (FCoV) bezeichnete wird. Bis Ende der 1990er Jahre wurde es in zwei verschiedene Viren unterteilt; gegenwärtig werden sie als Suptypen angesehen:
- Feline Enterale Coronavirus (FECV): wenig virulent
- Feline Infektiöse Peritonitis-Virus (FIPV): stark virulent, durch Mutation innerhalb der Katze entstanden
Das FCoV kommt weltweit vor, aber nur bei etwa 5–10 Prozent der infizierten, seropositiven Hauskatzen bricht die FIP-Erkrankung aus. Bezogen auf die gesamte Katzenpopulation hat die FIP eine Vorkommenshäufigkeit (Prävalenz) von 1–2 Prozent.
Die Inkubationszeit beträgt vermutlich bis zu vier Monate. Bereits am zweiten Tag nach der Infektion scheiden die Tiere das Virus über Kot, Nasensekret und Speichel aus. Die Virusausscheidung kann lebenslang anhalten. Die Übertragung des zunächst ungefährlichen Virus erfolgt vor allem durch Kontakt mit infiziertem Kot oder über verunreinigte Gegenstände. Auch eine Maul-zu-Maul- oder Maul-zu-Nase-Übertragung ist möglich. In der Umgebung ist das Virus bis zu eine Woche infektiös. Überdies können Menschen das Virus transportieren und auf die Katze übertragen. Oft infizieren virustragende Katzenmütter ihre Feten bereits während der Trächtigkeit. Die Übertragung der bereits mutierten Form spielt vermutlich keine Rolle bei der Verbreitung der Krankheit.
Prinzipiell sind alle Katzenarten und Altersgruppen für FIP empfänglich. Am häufigsten befällt die Erkrankung Tiere im Alter von sechs Monaten bis fünf Jahren und ältere Tiere ab 14 Jahren. Da wild lebende Katzen meist Einzelgänger ohne feste Kotplätze sind, sind Wildtiere deutlich seltener infiziert. Eingefangene verwilderte Hauskatzen sind zu etwa 10 Prozent seropositiv, nach wenigen Wochen in einem Tierheim dagegen fast 90 Prozent der Tiere. Bei Großkatzen sind ebenfalls besonders größere Bestände in Zoos gefährdet, Leoparden gelten als besonders empfänglich.
Entstehung (Pathogenese)

Die Entstehung der Erkrankung ist bislang nicht vollständig geklärt. Die Mutation der zunächst harmlosen FCoV-Variante in die sogenannten „FIP-Viren“ erfolgt im Darm und kann Jahre nach der Infektion erfolgen. Mit der Mutation erlangt das Virus die Fähigkeit, sich an Ribosomen der Fresszellen des Abwehrsystems (Monozyten und Makrophagen) zu binden und sich in diesen zu vermehren (Replikation). Durch die Virusvermehrung kommt es zum Zerfall der Fresszellen und die freiwerdenden Viruspartikel werden von anderen Fresszellen aufgenommen, wodurch sich das Virus im Körper ausbreitet. Durch die Abgabe von Zellbotenstoffen kommt es zur Aktivierung der die Blutgefäße auskleidenden Zellen (Endothelzellen) und damit zu einer Entzündung. Bestimmte Zellbotenstoffe führen auch zum Zelltod weiterer Abwehrzellen wie den Lymphozyten. Die nichtmutierte Variante vermehrt sich dagegen vorwiegend in den Darmepithelzellen des Leerdarms.
Man nimmt heute an, dass ob und in welcher Form die Krankheit letztendlich auftritt, vom Immunstatus des Einzeltieres abhängig ist. Bei einem Teil der Tiere bricht die Erkrankung trotz erfolgter Virusmutation aufgrund einer starken zellvermittelten Immunreaktion nicht aus. Das Immunsystem ist dadurch in der Lage, die infizierten Blutzellen unter Kontrolle zu halten. Diese Tiere bleiben ohne klinische Symptome, scheiden aber als latente Virusträger dieses weiter aus. Bei einem Teil der Tiere wird auch eine vollständige Viruselimination vermutet, wodurch sie allerdings für Neuinfektionen wieder empfänglich sind.
Klinisch erkennbar wird eine FIP vermutlich erst bei Störungen des Immunsystems, z. B. durch Stress oder andere Erkrankungen, die zu einer stärkeren Virusvermehrung im Darm führen. Einen Einfluss auf die Pathogenese hat die Bildung von Antikörpern, denn diese können das Virus nicht neutralisieren. Mit vermehrter Antikörperbildung werden auch vermehrt Makrophagen aktiviert, in denen es damit zu einer weiteren Virusvermehrung kommt. Das Paradoxon, dass die eigentlich zur Bekämpfung der Krankheitserreger gebildeten Antikörper zu einer Verschlimmerung der Krankheit führen („antikörperabhängige Verstärkung der Virusinfektion“, engl. antibody-dependent enhancement), wird auch bei Viruskrankheiten des Menschen (z. B. AIDS, Denguefieber) beobachtet. Dieses antibody-dependent enhancement spielt aber vermutlich nur bei experimentellen Infektionen eine Rolle.
Formen der FIP
Die Erkrankung wird in zwei Hauptformen, „feuchte“ und „trockene Form“, untergliedert. Dabei sind die Grenzen zwischen beiden Hauptformen fließend und nahezu jedes erkrankte Tier zeigt Komponenten beider Erscheinungsformen, von denen eine temporär dominieren kann. Die Unterteilung in feuchte und trockene Form ist strenggenommen eine Beschreibung der makroskopischen Befunde. Mikroskopisch bilden beide Formen meist ein identisches Bild aus. Daher wird die strikte Untergliederung in der neueren Literatur zunehmend als veraltet betrachtet.
Feuchte Form

Bei einer schwachen zellvermittelten Immunantwort kommt es zu einer anhaltenden Virusvermehrung im Blut (Virämie) und zur massiven Bildung von Immunkomplexen, zur Aktivierung des Komplementsystems und von Fresszellen (Makrophagen). Dies führt zu einer Blutgefäßentzündung (Vaskulitis) und zu einer lymphoplasmazellulären Perivaskulitis (durch Lymphozyten und Plasmazellen gekennzeichnete Entzündung in der Umgebung der Blutgefäße) der serösen Häute, die zu einem Gewebsuntergang (Nekrose) führt.
Einige Autoren sind allerdings der Meinung, dass es sich bei den Veränderungen um eine echte granulomatöse Vaskulitis und Perivaskulitis, also eine durch Fresszellen dominierte Entzündung der Gefäße und deren Umgebung handelt. Die lymphoplasmazelluläre Perivaskulitis stellt dann ein Spätstadium dar. Makroskopisch stellen sich diese Entzündungsherde als weißliche Knötchen dar. Durch die Entzündung kommt es auch zu einem Austritt von Serum und Proteinen in die Körperhöhlen und zu Fibrinablagerungen auf inneren Organen.
Trockene Form
Bei der „trockenen Form“ dominieren größere Knoten, die vorwiegend innerhalb der Organe entstehen. Es handelt sich dabei um verschmolzene Entzündungsherde, die wie bei der feuchten Form aus einer Vaskulitis/Perivaskulitis entstehen. Sie werden gelegentlich auch als „granulomatöse“ Veränderungen bezeichnet, es handelt sich aber nicht um eine echte granulomatöse Entzündung. Die Flüssigkeitsaustritte sind bei dieser Form nicht anzutreffen. Man nimmt an, dass sich diese Form bei einer weniger stark geschwächten zellvermittelten Immunantwort entwickelt und sie eine mildere, protrahierte Verlaufsform darstellt. Sie macht etwa 17 Prozent der FIP-Fälle aus, allerdings ist hier aufgrund der schweren Diagnostizierbarkeit (s. u.) mit einer erheblichen Dunkelziffer zu rechnen.
Symptome der FIP?
Katzen die klinisch an FIP erkranken zeigen als erstes meistens eine verminderte Futteraufnahme (Anorexie) und beginnen abzumagern. Dazu gesellt sich ein wiederkehrendes, behandlungsresistentes Fieber.
Die weiteren Symptome sind von der Form der Ausprägung abhängig, wobei fließende Übergänge zwischen beiden Formen auftreten können.
Feuchte Form
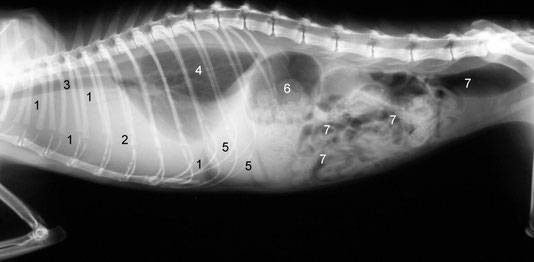
- Flüssigkeitsansammlungen in der Bauchhöhle (Bauchwassersucht, Aszites) oder in der Brusthöhle (Pleuraerguss). Die Flüssigkeitsansammlungen in der Bauchhöhle können als Umfangsvermehrung mit Fluktuation meist klinisch diagnostiziert werden.
- Flüssigkeitsansammlungen in der Brusthöhle können zu schwerer Atemnot führen.
Trockene Form
Die „trockene Form“ äußert sich in knotigen Veränderungen, vor allem im Bauchraum, aber auch das Gehirn, die Augen, die Organe der Brusthöhle oder lediglich die Haut können betroffen sein. Je nach Organlokalisation können Gelbsucht, Augenerkrankungen (Uveitis, Hornhautveränderungen „Hammelfettpräzipitate“, Blutungen oder Fibrinansammlungen in der vorderen Augenkammer, Retinitis, Blutarmut oder neurologische Erscheinungen (Krämpfe, Anfälle, Orientierungslosigkeit, Augenzittern, Lähmungen) auftreten.
Diagnose
- Anfangsverdacht: Jüngere Katze (< 6 Jahre) mit Fieber, das nicht auf Antibiotika anspricht.
- Flüssigkeitsansammlungen in den Körperhöhlen
- Vermehrter Gehalt an Globulinen im Blut (Hyperglobulinämie). Bestimmte Veränderungen des Blutbildes (mittlere bis schwere Anämie, Neutrophilie und Leukopenie) sind weitere Verdachtsmomente.
- Goldstandard: Immunhistochemische Nachweis des Coronavirus in Gewebsmakrophagen.
Alle anderen Verfahren sind zwar weniger invasiv, haben aber eine zum Teil deutlich geringere Aussagekraft.
Folgende labordiagnostische Testmethoden sind möglich:
- Rivalta-Probe: Durch eine Punktion wird Flüssigkeit aus einer betroffenen Körperhöhle entnommen. In einem Reagenzglas versetzt man destilliertes Wasser mit einem Tropfen Eisessig und gibt einen Tropfen des Punktats hinzu. Bei einer Infektion mit FIP löst sich der Tropfen nicht auf und sinkt nach unten. Ein negatives Testergebnis schließt eine FIP fast mit Sicherheit aus (Spezifität 98 Prozent), während ein positiver Test sie zwar wahrscheinlich macht, nicht aber beweist. Die Sensitivität beträgt nach neueren Untersuchungen nur 52 Prozent. Eine positive Rivaltaprobe kann auch bei eitriger Serositis und bei durch Tumoren bedingten Ergüssen auftreten. Die Sensitivität ist bei jungen Katzen höher, wenn man auch ältere Tiere untersucht, sinkt sie auf 65,5 Prozent.
- Antikörpernachweis im Punktat: Der Nachweis von Antikörpern in den Punktaten mittels Antikörperfärbung hat eine Sensitivität und Spezifität von etwa 85 Prozent.
- Antigennachweis in Makrophagen: Bei der feuchten Form kann aus dem Zentrifugat des Punktats ein Ausstrich angefertigt und mit einem Anti-Coronavirus-Konjugat versetzt werden. Die Sensitivität dieses Nachweisverfahrens wird je nach Studie mit 68–95 Prozent angegeben. Die Spezifität wurde in der Literatur lange mit 100 Prozent angegeben, eine aktuelle Studie lieferte jedoch drei falsch-positive Ergebnisse bei Katzen mit herzbedingtem Erguss (Spezifität 93 Prozent).
- Albumin-Globulin-Quotient: Die Bestimmung des Quotienten aus Albumin- und Globulin-Konzentration im Blut kann ebenfalls einen Hinweis auf die Erkrankung geben. Bei Quotienten kleiner als 1 besteht ein FIP-Verdacht, Werte unter 0,6 gelten als nahezu diagnostisch. Allerdings gibt es erhebliche Schwankungen hinsichtlich Sensitivität und Spezifität in Abhängigkeit von der Größe des Quotienten. Bei einem Quotienten von 0,9 liegt die Sensitivität bei 89 Prozent, die Spezifität bei 76 Prozent. Liegt der Wert unter 0,6, beträgt die Sensitivität nur noch 48 Prozent, die Spezifität hingegen bei 99 Prozent.
- Hohe Spiegel des sauren Alpha1-Glykoproteins, einem Akute-Phase-Protein, sind hinweisend für eine FIP.
- Antikörpernachweis im Blut: Ein positiver indirekter Antikörpernachweis im Blut ist nicht eindeutig. Er sagt nur aus, dass die Katze mit dem Coronavirus Kontakt hatte, auch wenn es sich nur um die harmlose Variante handelte. Die Sensitivität liegt bei 85 Prozent, die Spezifität allerdings nur bei 57 Prozent. Ein positiver Test mit einem Titer von kleiner als 1:1600 erhöht zwar die Spezifität auf etwa 98 Prozent, reduziert allerdings die Sensitivität auf 33 Prozent.
- Antigen-Antikörper-Komplex-Nachweis im Blut: Der Nachweis von Antigen-Antikörper-Komplexen mittels ELISA hat nur eine Sensitivität von etwa 50 Prozent, die Spezifität liegt bei 91 Prozent.
- FCoV-RT-PCR: Über ein RT-PCR-Verfahren lässt Coronavirus-RNA und damit eine Virämie nachweisen. Die Sensitivität liegt bei Untersuchung von Blut bei etwa 15 Prozent, bei Untersuchung von mononukleären Zellen bei 29 Prozent. Die Spezifität beträgt 86–100 Prozent. Die Nachweis von Virus-RNA ermöglicht keine Unterscheidung zwischen harmlosen und mutierten Coronaviren. Bei der RT-PCR aus Ergussflüssigkeit sind Sensitivität und Spezifität dagegen hoch (> 90 Prozent). Der Nachweis im Kot dient nur der Erkennung von Coronavirusausscheidern, für die Diagnose der Erkrankung ist er ungeeignet.
Eine Kombination verschiedener Verfahren erhöht die diagnostische Aussagekraft!
Eine Bestimmung der durch Hämolyse freigesetzten Lactatdehydrogenase (ein Enzym, das Laktat in Pyruvat umwandelt) kann einen weiteren Hinweis auf die Erkrankung geben, ebenso die die Bestimmung der bei Katzen meist durch FIP verursachten Erhöhung des Bauchspeicheldrüsenenzyms alpha-Amylase.
Während ein Antigennachweis im Erguss als beweisend gilt, ist die „trockene Form“ nur schwierig nachzuweisen. Die Nachweismethoden 4–8 sind ebenfalls möglich, allerdings gilt bislang nur der pathohistologische Nachweis als aussagekräftig für das Vorhandensein der FIP. Dabei ist der immunhistochemische Antigennachweis an formalinfixiertem Gewebe sensitiver als an frischem Gewebe.
Es gibt FIP-Katzen ohne jegliche Veränderungen dieser Parameter als auch Tiere, die trotz markanter Abweichungen dieser Parameter keine FIP haben. Ein Nachweis der Antikörper in Gewebsproben (Bioptat) von Lunge, Leber, Niere und Lymphknoten gilt als beweisend, es gibt aber Kreuzreaktionen mit der harmlosen FCoV-Variante und anderen Coronaviren (Canines Coronavirus, TGE-Virus), für die Katzen zwar prinzipiell empfänglich sind, aber die keine FIP auslösen. Ein PCR-Virusnachweis in Geweben ist ebenfalls kommerziell erhältlich.
Seit 2012 gibt es eine Nachweismethode, die eine eindeutige molekularbiologische Charakterisierung der beiden Coronavirus-Varianten verspricht. Hierbei werden mittels PCR Mutationen in zwei Spike-Proteinen nachgewiesen, die mit der mutierten Variante und damit der FIP in direkter Beziehung stehen. Dieser Test ist seit 2013 auch kommerziell verfügbar und kann an Punktaten von Ergüssen, Liquor cerebrospinalis und Kammerwasser sowie an EDTA-Blut erfolgen.
Differentialdiagnosen
Bei der recht typischen feuchten Form müssen andere Ursachen für eine Bauchwassersucht und/oder einen Pleuraerguss ausgeschlossen werden. Hierzu zählen vor allem:
- Herzerkrankung
- Proteinmangel im Blut (Hypoproteinämie)
- Stauungsergüsse durch Tumorerkrankungen
- Blutungen oder eine bakterielle Pleuritis bzw. Peritonitis
- Streptotrichose (früher für eine Pilzerkrankung gehaltene eitrige bakterielle Pleuritis, die Flüssigkeit ist hier aber bräunlich-trüb), selten
- Ruptur des Ductus thoracicus (Chylothorax)
Ein Großteil dieser Erkrankungen kann aufgrund des hierdurch bedingten relativ geringen Proteingehaltes des Ergusses (Transsudat) sowie durch das Fehlen von Tumorzellen oder Bakterien recht einfach ausgeschlossen werden.
Bei therapieresistentem Fieber oder knotigen Veränderungen:
Feline Leukämie
Immundefizienzsyndrom der Katzen
Panleukopenie
Lymphosarkome
Yersiniose
Tyzzersche Krankheit
Therapie
Eine klinisch manifeste FIP führt ohne spezifische Behandlung binnen weniger Wochen zum Tod, vor allem jüngere Tiere mit der „feuchten Form“ haben eine geringe Überlebenszeit. Die mittlere Überlebenszeit beträgt neun Tage, 95 Prozent der erkrankten Tiere sterben innerhalb eines Jahres. Es kann also eine von 20 Katzen durchaus noch länger als ein Jahr leben, so dass eine Einschläferung nicht unmittelbar angezeigt ist.
FIP ist jedoch mittlerweile heilbar.
Bei der Studie von Niels C. Pedersen aus dem Jahre 2018 wurde an 31 Katzen das antivirale Mittel GS-441524 eingesetzt, dem eigentlich wirksamen Hauptmetabolit von Remdesivir. Dieser Feldversuch zeigte, dass das chemisch weniger komplexe 'GS-441524' hochwirksam war und dass sich damit vielversprechende Behandlungserfolge bei Katzen mit natürlich vorkommender FIP zeigten. Diese Ergebnisse wurden am 13. Februar 2019 im Journal of Feline Medicine and Surgery (JFMS) veröffentlicht. In einer Münchner Studie aus dem Jahr 2021 konnten alle 18 Tiere mit diesem Wirkstoff geheilt werden, wobei sich der Wirkstoff als gut verträglich erwies.
Hauptproblem der Behandlung mit GS-441524 ist, dass dieser Wirkstoff in der EU nicht zugelassen ist. Die Einfuhr ist daher nach § 96 Nr. 4 AMG eine Straftat, so dass niedergelassene Tierärzte diese Behandlung nicht durchführen dürfen.
Unterstützend zur Behandlung mit GS-441524 ist die Verminderung des Infektionsdruckes innerhalb des Haushalts oder des Bestandes. Das Prinzip besteht darin, die potentiell krankmachenden FCoV-Viren lediglich so weit wie möglich auszudünnen und ist mit einfachen hygienischen Methoden bereits durchführbar. Als mögliche Maßnahmen werden empfohlen:
- Aufstellen möglichst vieler Kotkisten, welche mehrmals täglich gereinigt werden sollten
- wenn möglich Verwendung immer der gleichen Trink- und Futtergefäße und deren tägliche Reinigung
- Haltung der Katzen in Kleingruppen von 3 bis 4 Tieren
- Entfernung von starken Virusausscheidern aus der Gruppe
- Muttertiere 2 Wochen vor dem Wurf aus der Gruppe entfernen und separate Aufzucht der Jungtiere.
Prophylaxe
- Impfung: Die Impfung gegen FIP wird kontrovers diskutiert. Prinzipielles Problem ist hierbei, dass eine systemisch applizierte Vakzine (Impfstoff) bei den verwendeten Stämmen die Gefahr der Entstehung einer FIP durch das Impfvirus in sich birgt, das Impfvirus mit dem Feldvirus vermengt werden kann und sich infektionsverstärkende Antikörper bilden. Das Ziel des verfügbaren Impfstoffes ist daher die Erzeugung einer lokalen Immunantwort auf zellulärer Ebene und auf Basis von lokalem IgA im Bereich der Eintrittspforte der Viren im Nasen-Rachenbereich. Daher wird die Vakzine in die Nase eingetropft. Die lediglich lokale Wirkung der Vakzine ist hierbei dadurch gewährleistet, da sich der Impfstamm nur bei einer Temperatur von 31 °C vermehren kann. Bei bereits FCoV-positiven Tieren (auch durch die harmlose Variante) versagt das Prinzip der Impfung. Sie ist daher nur bedingt zu empfehlen. Sinnvoll ist sie bei seronegativen Katzen in größeren Beständen sowie einzeln in Wohnungen gehaltenen Tieren, die durch zufälligen Kontakt mit eingeschlepptem Virusmaterial (z. B. Kot an den Schuhen der Besitzer) infolge des massiven „Virusloads“ in ihrer Immunantwort überfordert wären. Die Schutzwirkung des Impfstoffs (Primucell FIP®) erbrachte in klinischen Studien sehr unterschiedliche Resultate. Je nach Studie wurde eine Effizienz zwischen 0 (für keine Schutzwirkung) und 75 Prozent angegeben.
- Early Weaning (engl. für frühes Absetzen): Den Versuch, die Ausbreitung der harmlosen Ausgangsvariante des Virus zu verhindern, verfolgt das Konzept des Early Weaning, das 1992 von Addie & Jarrett vorgestellt wurde. Hierbei wird die trächtige Mutterkatze zwei Wochen vor der Geburt von anderen Katzen isoliert und die Geburt und Jungkatzenaufzucht strikten Hygienebedingungen unterworfen. Mit fünf bis sechs Wochen werden die Kätzchen von der Mutter abgesetzt und von ihr getrennt, weil sie nur bis zu diesem Zeitpunkt durch mütterliche Antikörper geschützt sind und danach von ihr das Virus übertragen bekommen könnten. Im Gegensatz zu Erfolgen in Großbritannien, bei denen alle Jungkatzen anschließend FCoV-seronegativ waren, ließ sich dieses Resultat in einer deutschen Studie nicht reproduzieren.
Teilen Sie diese Seite Gerne
Bildnachweise

Nilses, Public domain, via Wikimedia Commons

Kalumet, Phrood, CC BY-SA 3.0 via Wikimedia Commons

Kalumet, CC BY-SA 3.0 via Wikimedia Commons

Uwe Gille, CC BY-SA 3.0 via Wikimedia Commons
Kategorien
# Feline Infektöse Peritonitis
# Infektionskrankheit
# Katzenkrankheit
Quellennachweise
2023
Wikipedia, zugeletzt abgerufen 20.06.2023
2021
Robert Hertzsch und Angelika Fischer: GS-441524 zur FIP-Behandlung aktuell nicht legal! In: Dt. TÄBl. Band 69, Nummer 7, S. 810.
D. Krentz et al.: Curing cats with feline infectious peritonitis with an oral multicomponent drug containing GS-441524. In: Viruses Band 13, S. 228.
2020
M. A. Kennedy: Feline Infectious Peritonitis: Update on Pathogenesis, Diagnostics, and Treatment. In: The Veterinary clinics of North America. Small animal practice. Band 50, Nummer 5, September 2020, S. 1001–1011, doi:10.1016/j.cvsm.2020.05.002, PMID 32563530 (Review).
2019
Pedersen NC, Perron M, Bannasch M, et al.: Efficacy and safety of the nucleoside analog GS-441524 for treatment of cats with naturally occurring feline infectious peritonitis. In: J Feline Med Surg. Band 21, Nr. 4, 2019, S. 271‐281. doi:10.1177/1098612X19825701
2018
Friederike Riemer: Klinische Symptome und laborparametrische Veränderungen bei Katzen mit feliner infektiöser Peritonitis. Dissertation an der Tierärztliche Fakultät der LMU München, 2018 (PDF; 3,8 MB)
D. R. Rissi: A retrospective study of the neuropathology and diagnosis of naturally occurring feline infectious peritonitis. In: Journal of veterinary diagnostic investigation : official publication of the American Association of Veterinary Laboratory Diagnosticians, Inc. Band 30, Nummer 3, Mai 2018, S. 392–399, doi:10.1177/1040638718755833, PMID 29411701.
2017
S. J. Doenges, K. Weber, R. Dorsch, R. Fux, K. Hartmann: Comparison of real-time reverse transcriptase polymerase chain reaction of peripheral blood mononuclear cells, serum and cell-free body cavity effusion for the diagnosis of feline infectious peritonitis. In: Journal of feline medicine and surgery. Band 19, Nr. 4, April 2017, S. 344–350, doi:10.1177/1098612X15625354, PMID 26787293.
2016
Marian C. Horzinek: Lässt sich die Feline Infektiöse Peritonitis (FIP) beherrschen? In: Kleintiermedizin Nr. 5, 2016, S. 210–217.
Kim Yunjeong et al.: Reversal of the Progression of Fatal Coronavirus Infection in Cats by a Broad-Spectrum Coronavirus Protease Inhibitor. In: PLOS pathogens 2016, doi:10.1371/journal.ppat.1005531
2014
Jürgen Kremendahl: Feline infektiöse Peritonitis – ein aktueller Überblick. In: kleintier konkret. Band 17, Nr. 2, 2014, S. 10–14, doi:10.1055/s-0033-1361536
2013
Deutsches Tierärzteblatt. Band 61, 2013, S. 281.
Susanne Held, Reto Neiger: Ätiologie, Epidemiologie und Diagnose der Felinen Infektiösen Peritonitis (FIP). In: Kleintierpraxis. Band 58, 2013, S. 80–96.
Susanne Held: Genauigkeit diagnostischer Tests für Feline Infektiöse Peritonitis (FIP) bei Katzen mit einem Körperhöhlenerguss. Veterinärmedizinische Dissertation Gießen 2013; Deutsche Veterinärmedizinische Gesellschaft, Gießen 2014, ISBN 978-3-86345-201-8. (Digitalisat).
2012
Yvonne Fischer: Untersuchungen zur Diagnose und Therapie der felinen infektiösen Peritonitis. Dissertation an der Tierärztliche Fakultät der LMU München, 2012 (PDF; 4,7 MB)
Hui-Wen Chang, Herman F. Egberink, Rebecca Halpin, David J. Spiro, Peter J. M. Rottier: Spike protein fusion peptide and feline coronavirus virulence. In: Emerging Infectious Diseases. Band 18, Nr. 7, Juli 2012, ISSN 1080-6059, S. 1089–1095, doi:10.3201/eid1807.120143, PMID 22709821, PMC 3376813 (freier Volltext).
Y. Fischer, C. Sauter-Louis, K. Hartmann: Diagnostic accuracy of the Rivalta test for feline infectious peritonitis. In: Veterinary clinical pathology / American Society for Veterinary Clinical Pathology. Band 41, Nummer 4, Dezember 2012, S. 558–567, doi:10.1111/j.1939-165X.2012.00464.x, PMID 22913882.
2010
Katrin Hartmann: Feline infectiöse Peritonitis – Diagnose, Behandlung und Prophylaxe. In: Kleintierpraxis. Band 55, 2010, ISSN 1434-9132, S. 561–572.
2006
Susanne Ritz, Herman Egberink, Katrin Hartmann: Effect of Feline Interferon-Omega on the Survival Time and Quality of Life of Cats with Feline Infectious Peritonitis. In: Journal of Veterinary Internal Medicine. Band 21, Nr. 6, 2006, ISSN 0891-6640, S. 1193–1197, doi:10.1111/j.1939-1676.2007.tb01937.x.
2005
Katrin Hartmann: Feline infectious peritonitis. In: The Veterinary Clinics of North America. Small Animal Practice. Band 35, Nr. 1, 2005, ISSN 0195-5616, S. 39–79, doi:10.1016/j.cvsm.2004.10.011.
A. Kipar, H. May, S. Menger, M. Weber, W. Leukert, M. Reinacher: Morphologic Features and Development of Granulomatous Vasculitis in Feline Infectious Peritonitis. In: Veterinary Pathology. Band 42, Nr. 3, 2005, ISSN 0300-9858, S. 321–330. PMID 15872378, doi:10.1354/vp.42-3-321.
2004
John Stavrinides, David S. Guttman: Mosaic evolution of the severe acute respiratory syndrome coronavirus. In: Journal of Virology. Band 78, Nr. 1, 2004, ISSN 0022-538X, S. 76–82. PMID 14671089, doi:10.1128/JVI.78.1.76-82.2004.
2003
Katrin Hartmann et al.: Comparison of different tests to diagnose feline infectious peritonitis. In: Journal of veterinary internal medicine. Band 17, Nummer 6, 2003 Nov-Dec, S. 781–790, doi:10.1111/j.1939-1676.2003.tb02515.x, PMID 14658713, PMC 7197515 (freier Volltext).
2001
Christina Binder: Vergleich verschiedener Parameter zur Diagnose der felinen infektiösen Peritonitis. München 2001 (München, Universität, Dissertation, 2001).
1998
Harry Vennema, Amy Poland, Janet Foley, Niels C. Pedersen: Feline infectious peritonitis viruses arise by mutation from endemic feline enteric coronaviruses. In: Virology. Band 30, Nr. 1, 1998, S. 150–157, doi:10.1006/viro.1998.9045.
1996
Wilfried Kraft, Ulrich M. Dürr: Katzenkrankheiten. Hrsg.: W. Kraft. 4. Auflage. M & H Schaper, Hannover 1996, ISBN 3-7944-0178-6, S. 138.
1992
D. D. Addie, J. O. Jarrett: A study of naturally occurring feline coronavirus infections in kittens. In: Veterinary Record. Band 130, 1992, S. 133–137, doi:10.1136/vr.130.7.133.
1987
Niels C. Pedersen: Virologic and immunologic aspects of feline infectious peritonitis virus infection. In: Advances in Experimental Medicine and Biology. Band 218, 1987, ISSN 0065-2598, S. 529–550, doi:10.1007/978-1-4684-1280-2_69.
Kennen Sie einen Hund der schlecht aufstehen kann und unsicher läuft oder einen Hund mit Handicap?
Dr. Buzby's ToeGrips®, kleine Gummiringe die Hunden auf die Krallen aufgezogen werden, geben sofortigen Halt und Zutrauen.
Ein ebenso einfaches wie geniales Produkt für alle gangunsicheren Hunde, ältere Hunde und Hunde mit Handicap.




